Virale RNA löst kritische Schritte im Lebenszyklus des Lassavirus aus
Forschende untersuchen Virusmoleküle mit nativer Massenspektrometrie
Um neue antivirale Medikamente gegen das Lassavirus entwickeln zu können, ist ein Verständnis viraler Prozesse in menschlichen Wirtszellen zentral. Wissenschaftler:innen von verschiedenen Institutionen, darunter das Bernhard-Nocht-Institut für Tropenmedizin (BNITM) und das Centre for Structural Systems Biology (CSSB), untersuchten Wechselwirkungen von viralen Molekülen mit nativer Massenspektrometrie. Ein bedeutendes Ergebnis: RNA löst die Aufspaltung eines festen Verbunds dreier Proteinmoleküle in einzelne Proteinmoleküle aus. Dieser Prozess ist eine Voraussetzung dafür, dass die virale Erbinformation geschützt und vermehrt werden kann. Die Ergebnisse wurden in der Fachzeitschrift Journal of the American Chemical Society veröffentlicht.
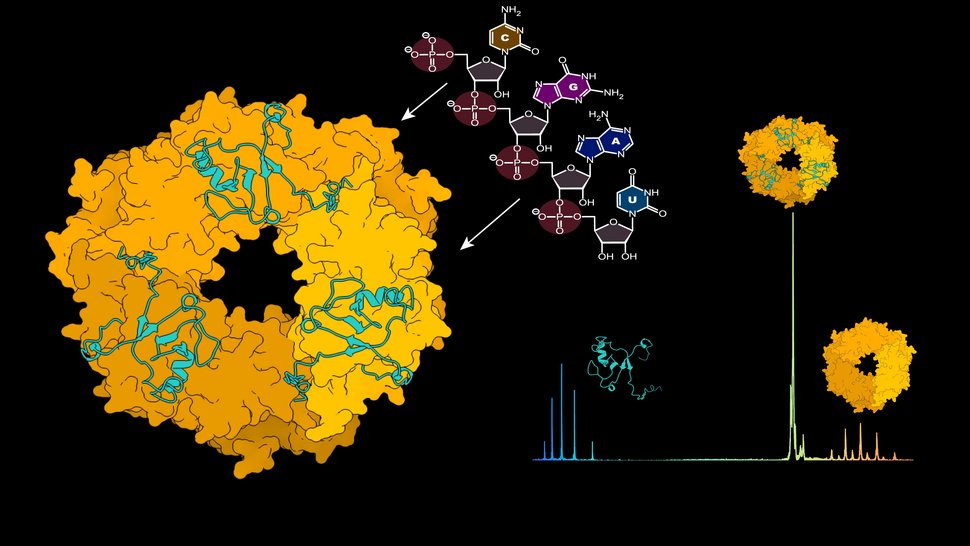
Links: Strukturvorhersage der ringförmigen Trimerstruktur des Nukleoproteins (gelb), dargestellt im Komplex mit dem Z-Protein (türkis). RNA löst die Aufspaltung des Trimers aus. Rechts: Natives Massenspektrum der Moleküle Z-Protein, NP-Trimer und NP-Trimer im Komplex mit dem Z-Protein.
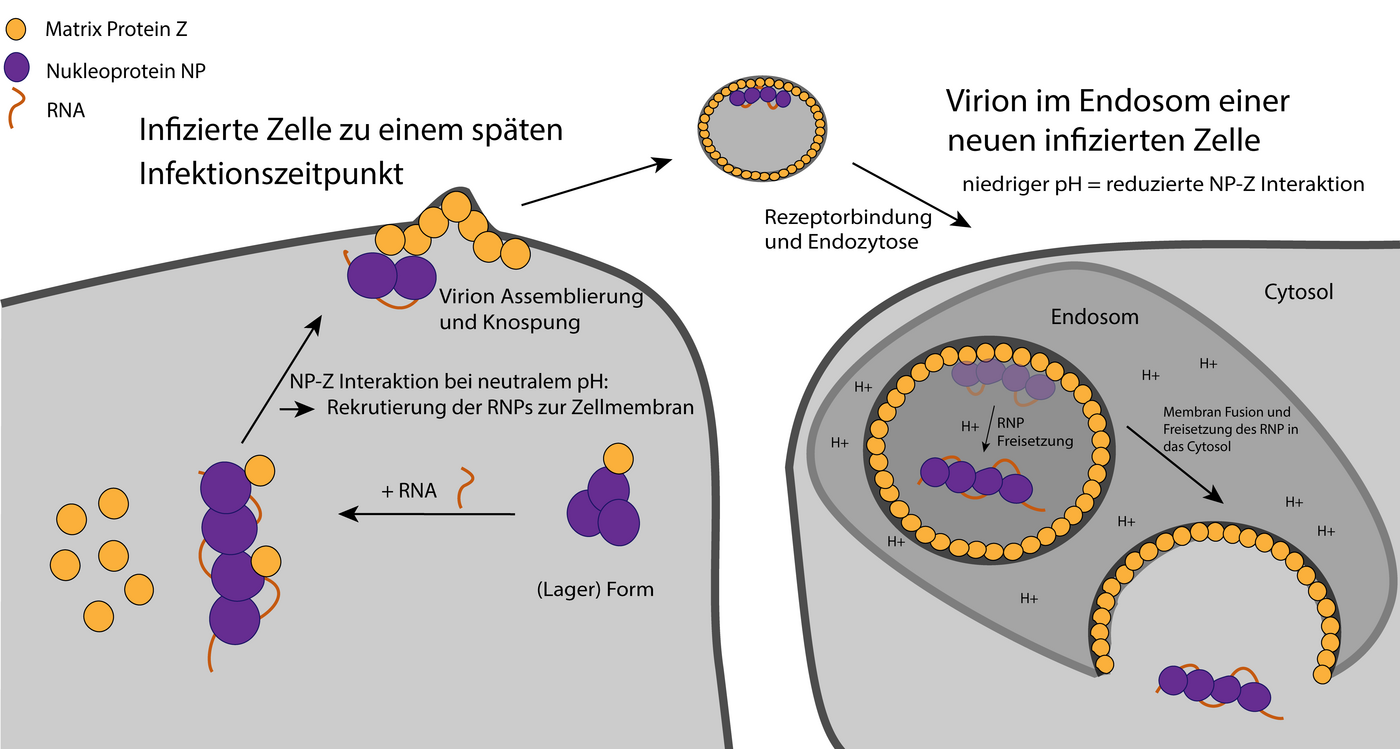
Das Lassavirus (LASV) gehört zur Familie der Arenaviren und ist ein RNA-Virus, das heißt, es speichert seine Erbinformation im Gegensatz zu DNA-Viren in Form von RNA. Das Lassavirus kommt in westafrikanischen Ländern vor und kann das hämorrhagische Lassafieber auslösen. Jährlich infizieren sich zwischen 100.000 und 300.000 Menschen mit dem LASV, von denen ca. 5.000 Personen sterben. Um die Krankheit auszulösen, muss sich das Virus effizient in den Zellen der infizierten Person vermehren. Wesentliche Schritte im Lebenszyklus des Lassavirus sind der Eintritt in die menschliche Wirtszelle, die Vervielfältigung der Viren-RNA, das Verpacken der neuen Viren-RNA mit viruseigenen Proteinen und der Austritt aus der Wirtszelle.
Virale RNA triggert Trimerspaltung des Nukleoproteins
Die Forschenden um Dr. Maria Rosenthal, Gruppenleiterin der BMBF Nachwuchsgruppe Strukturelle Virologie, konzentrierten sich in dieser Arbeit auf das sogenannte Nukleoprotein (NP) des Lassavirus. Das Nukleoprotein umhüllt die virale Erbinformation und schützt so die virale RNA vor dem Abbau in der menschlichen Wirtszelle. Nukleoproteine liegen zunächst als stabile, ringförmige Trimere vor - dies sind feste Verbunde von drei Nukleoprotein-Molekülen. Aufgrund ihrer Ringstruktur können die Trimere keine RNA binden. Es war nicht bekannt, wie diese Trimerstruktur aufgebrochen wird.
„Wir konnten zeigen, dass die virale RNA selbst den Zerfall des Trimers in einzelne Proteinmonomere auslöst, welche dann an die neu produzierte virale RNA rekrutiert werden können“, so die Forschungsgruppenleiterin.
Das Forschungsteam nutzte für seine Versuche die Methode der nativen Massenspektrometrie am CSSB unter der Leitung von Prof. Dr. Charlotte Uetrecht. Diese Methode funktioniert wie eine extrem feine Waage, mit der die Forschenden kleinste Moleküle in ihrer natürlichen (= nativen) Form messen können. „Da die Proteine und auch die Proteinkomplexe ihre native Form behalten, können wir genau messen, wie viele RNA-Moleküle mit einem Protein verbunden sind oder ob Proteinmonome, Dimere oder Trimere vorliegen“, erläutert Lennart Sänger, Erstautor der Veröffentlichung.
Nukleoprotein als möglicher Angriffspunkt für künftige antivirale Medikamente
Damit komplette Viren aus der Wirtszelle austreten können, müssen die Nukleoproteine mit der nun an sie gebundenen und damit geschützten viralen RNA an die Zellmembran befördert werden. Dafür verantwortlich ist das virale Z-Protein. Eine Störung dieses Transportprozesses könnte eine mögliche Strategie für die Entwicklung eines antiviralen Medikaments darstellen. Die Interaktion von Nukleoprotein, RNA und Z-Protein war bisher nicht im Detail verstanden. Die Forschenden am BNITM und ihre Kooperationspartner:innen konnten nun zeigen, dass das Nukleoprotein und das Z-Protein direkt aneinander binden.
„Wichtig für diese Bindung ist eine bestimmte Stelle im Nukleoprotein. Zukünftig könnte diese Stelle als Angriffspunkte für antivirale Medikamente genutzt werden“, erklärt Sänger.
pH-Wert wichtig für Viruseintritt in die Wirtszelle
RNA beeinflusste die Bindung zwischen dem Z- und dem Nukleoprotein nicht, jedoch konnten die Wissenschaftler:innen zeigen, dass die Bindung abhängig vom pH-Wert war: Je saurer das Milieu (= niedriger pH-Wert), desto weniger interagierten die Nukleo- und die Z-Proteine miteinander. Die Ergebnisse helfen beim Verständnis des Viruseintritts in die Wirtszelle. Nachdem das Lassavirus in die Wirtszelle eingedrungen ist, liegt es in dem sogenannten Zellkompartiment Endosom vor, welches ein saures Milieu aufweist. Die Forschenden konnten zeigen, dass der niedrige pH-Wert des Endosoms wichtig ist, damit sich die Nukleoproteine mit der viralen Erbinformation von der Virushülle bestehend aus Z-Proteinen lösen können.
„Mithilfe einer strukturbiologischen Methode, der nativen Massenspektrometrie, konnten wir wichtige Schritte im Lebenszyklus des Lassavirus weiter aufklären. Ein besseres Verständnis der Wechselwirkungen viraler Moleküle kann uns helfen, antivirale Medikamente zu entwickeln“, schließt die Strukturbiologin Rosenthal.
Originalpublikation
Sänger L. et al. „RNA to Rule Them All: Critical Steps in Lassa Virus Ribonucleoparticle Assembly and Recruitment.” J. Am. Chem. Soc. (2023)
Institutionen der Kooperationspartner:innen
Centre for Structural Systems Biology (CSSB)
Leibniz Institute of Virology (LIV)
European Molecular Biology Laboratory (EMBL) Hamburg
Fraunhofer Institute for Translational Medicine and Pharmacology (ITMP)
Faculty V, School of Life Sciences, University of Siegen
Deutsches Elektronen-Synchrotron (DESY)
Funding
Leibniz Center Infection Graduate School and Leibniz Interact
The Leibniz Institute of Virology was supported by the Free and Hanseatic City of Hamburg and the Federal Ministry of Health
German Federal Ministry of Education and Research
Deutsche Forschungsgemeinschaft (DFG)
Leibniz Association’s Leibniz competition programme and grant
Horizon 2020 ERC
BWFBG of the Free and Hanseatic City of Hamburg for an equipment grant
Wilhelm und Maria Kirmser-Stiftung
Ansprechperson
Dr. Maria Rosenthal
Gruppenleiterin
Telefon : +49 40 285380-930
E-Mail : rosenthal@bnitm.de
Lennart Sänger
Telefon : +49 40 285380-930
E-Mail : lennart.saenger@bnitm.de
Dr. Anna Hein
Presse- & Öffentlichkeitsarbeit
Telefon : +49 40 285380-269
E-Mail : presse@bnitm.de
Weiterführende Informationen






